GURU VOKASI - Atom adalah satuan partikel terkecil yang masih memiliki sifat unsur. Menurut ahli,jari-jari atom sekitar 3-15 nm. Para ahli melakukan pengamatan mengenai gejala-gejala tentang atom dan mengira-ngira bentuk atom sehingga dikenal sebagai teori model atom. Berikut merupakan perkembangan teori model atom menurut beberapa ahli.
a. Aristoteles (384 - 332 SM), seorang ahli filsafat Yunani,
menyatakan bahwa materibersifat kontinu, artinya setiap materi dapat dibagi secara terus menerus sampai tak terhingga.
b. Democritus (460 - 370 SM), seorang ahli filsafat Yunani,
menyatakan bahwa materi bersifat diskontinu, artinya bila setiap materi dibagi atau dibelah secara terus menerus maka pada suatu saat akan didapatkan suatu bagian yang tidak dapat dibagi lagi. Bagian tak terbagi lagi itu disebut atom (a = tidak; tomos = terbagi).
a. Model Atom Dalton
 |
| model atom dalton |
- Unsur kimia tersusun oleh partikel-partikel kecil yang tidak dapat dihancurkan dan dipisahkan yang disebut atom.
- Setiap atom dari suatu unsur memiliki massa dan sifat yang sama, namun berbeda dengan unsur lainnya
- Dua atom atau lebih membentuk senyawa dengan perbandingan tetap dan tertentu.
b. Model Atom Thomson
Pada tahun 1897 Joseph John Thomson melakukan eksperimen dengan tabung sinar katode dan menemukan bahwa sinar katode adalah berkas partikel bermuatan negatif yang disebut dengan elektron yang ada pada setiap materi. Model atom Thomson digambarkan seperti roti kismis, di mana atom terdiri atas materi bermuatan positif
dan di dalamnya tersebar elektron bagaikan kismis yang terdapat dalam roti kismis. Muatan positif dan negatif dalam atom memiliki jumlah yang sama maka secara keseluruhan, atom menurutThomson bersifat netral.
c. Model Atom Rutherford
Pada tahun 1910, Rutherford bersama Hans Geiger dan Ernest Marsden melakukan percobaan penembakan foil emas dengan partikel alfa berenergi tinggi. dan menghasilkan sebuah kesimpulan bahwa
- Sebagian besar partikel alfa dapat menembus lempeng logam karena melalui ruang hampa (partikel A).
- Dikarenakan inti atom dan partikel alfa keduanya bermuatan positif (partikel B). Sehingga partikel alfa yang mendekati inti atom akan mengalami pembelokan
- Partikel yang dipantulkan adalah partikel alfa yang menabrak inti atom (partikel C)
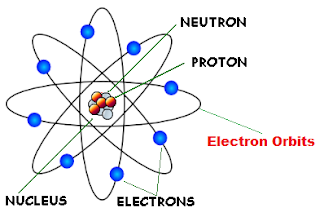
- Atom tersusun atas elektron-elektron yang bermuatan negatif yang mengelilingi inti.
- Inti atom bermutatan positif disebabkan karena proton berkumpul didalam inti atom.
- Sebagian besar ruang dalam atom adalah ruang hampa.
- jumlah elektron yang mengelilingi inti sama dengan jumlah proton didalam inti atom, sedangkan atom bersifat netral.
Berdasarkan gambar diatas dapat disimpulkan bahwa atom terdiri atas inti atom yang bemuatan positif dan dikelingi oleh elektron yang memiliki jarak yang relatif sangat jauh.Lintasan elektron itu disebut kulit atom. dan yang dinamakan dengan jari jari atom adalah jarak antara kulit atom sampai dengan inti atom. Ukuran jari-jari atom adalah sekitar 10⁻⁸ cm dan ukuran jari-jari inti atom adalah sekitar 10⁻¹³ cm
d. Model Atom Niels Bohr
Bohr menyempurnakan model atom Rutherford. Dengan teori Mekanika Kuantum Planck, Bohr menyampaikan 2 postulat yang menjelaskan kestabilan atom, yaitu:
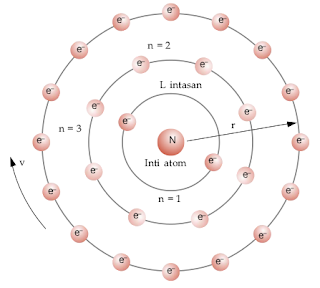
- Elektron mengelilingi inti atom pada lintasan tertentu yang stasioner yang disebut orbit/kulit sehingga elektron tidak jatuh ke inti.
- Elektron dapat berpindah dari kulityang satuke kulit yang lain dengan memancarkan atau menyerap energi yang disebut dengan energi foton.
Niels Bohr mengemukakan model atom hidrogen. Dalam atom, elektron-elektron mengelilingi inti pada lintasan-lintasan atau tingkat-tingkat energi tertentu. Selama bergerak mengelilingi inti, elektron tidak menyerap energi dan tidak melepas energi (keadaan stasioner). Elektron dapat pindah ke tingkat energi lebih tinggi (eksitasi) dengan menyerap energi dan pindah ke tingkat lebih rendah dengan memancarkan energi.Tingkat-tingkat energiitu disebut dengan kulit-kulit atom. Setiap kulit ditandai dengan bilangan bulat (n) yang disebut bilangan kuantum utama.Nilai n = 1 (kulit K),n = 2 (kulit L),n = 3 (kulit M),dan seterusnya.
e. Model Atom Mekanika Kuantum
- Louis De Broglie pada tahun 1923, menyatakan bahwa atom mempunyai sifat dualisme, yaitu sebagai partikel dan sebagai gelombang.
- Werner Heisenberg, menyatakan bahwa terdapat asas ketidakpastian di mana tidak mungkin menentukan posisi dan momentum elektron yang pasti dalam atom.
- Pada tahu 1926 Erwin Schrodinger, menyatakan bahwa volume ruang yang memiliki kebolehjadian terbesar untuk menentukan elektron yang disebut juga dengan orbital atom
Terimakasih telah berkunjung di website kami, jika artikel ini bermnafaat jangan lupa untuk share materi tersebut di media sosial anda
covid19, obat kangker, obat jerawat, kredit mobil, kredit motor, nilai saham tertinggi
MATERI DAN CONTOH SOAL LAINNYA
Rangkuman Materi dan Perubahan Unsur Kimia
Ringkasan Materi Kimia Sistem Periodik Unsur
Ringkasan Materi Perkembangan Teori Model Atom
Rangkuman Materi Bilangan Kuantum
Rangkuman Materi Konfigurasi Elektron
20 Soal dan Kunci Jawaban Struktur Atom
30 Latihan dan Kunci Jawaban Soal Struktur Atom
Latihan Soal Struktur Atom, Sistem Periodik dan Ikatan Kimia |
Ringkasan Materi Kimia Sistem Periodik Unsur
Ringkasan Materi Perkembangan Teori Model Atom
Rangkuman Materi Bilangan Kuantum
Rangkuman Materi Konfigurasi Elektron
20 Soal dan Kunci Jawaban Struktur Atom
30 Latihan dan Kunci Jawaban Soal Struktur Atom
Latihan Soal Struktur Atom, Sistem Periodik dan Ikatan Kimia |









Tidak ada komentar:
Posting Komentar